Um novo ingrediente ativo inspirado pela natureza debaixo do mar
Na busca interminável de novas fontes interessantes de ingredientes ativos, grande parte da atenção nos dias de hoje mudou para ingredientes de origem marinha. Um grande número de espécies marinhas ainda não foi extensivamente estudado. Isto faz novas descobertas que propõem efeitos benéficos para nossa pele, altamente interessantes para a indústria de cosméticos. Um dos habitantes fascinantes do mar é a anêmona do mar, conhecida por muitos como o abrigo dos peixes palhaço. Um fato menos conhecido é que, como a anêmona do mar é macia e vulnerável, produz um veneno para se proteger de predadores e também para imobilizar presas. Recentemente, os cientistas descobriram que uma proteína componente do veneno da anêmona do mar Heteractis crispa é um potente inibidor do receptor da dor TRPV1, que oferece uma abordagem interessante para a pele sensível.
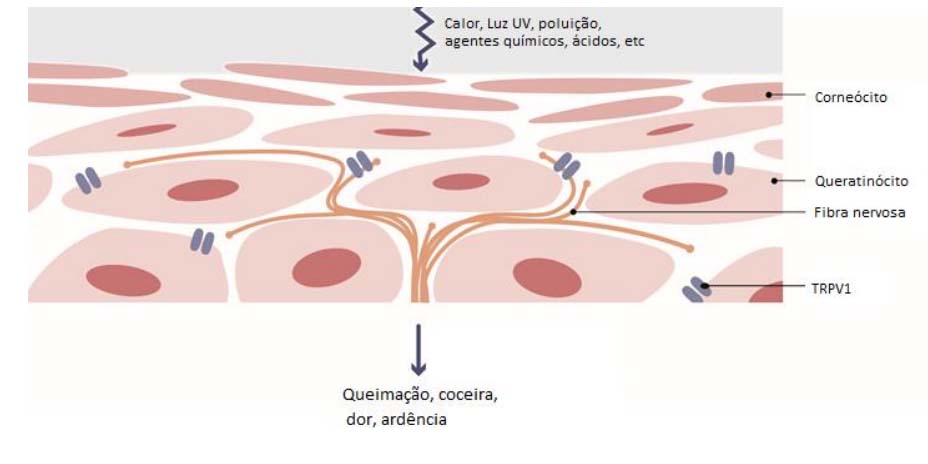
TRPV1, receptor da dor é hiperativo em peles sensíveis
O receptor TRPV1 é responsável pela transmissão da sensação de dor ao entrar em contato com calor, produtos químicos e ácidos. Está presente em nossa pele, pois esta é a primeira barreira que encontra estresse ambiental. Embora a atividade do receptor seja importante para nos proteger de danos, como reagir com a dor e retirar a mão ao tocar uma superfície quente, uma hiperatividade pode ser prejudicial também. A pele sensível é especialmente caracterizada por um receptor de dor hiper-reativa que se manifesta como a pele que se sente muito apertado, coceira e até mesmo queima – mesmo que não existem influências nocivas sobre a pele. Além de ser responsável pelo desconforto da pele, o receptor TRPV1 também está envolvido no envelhecimento da pele. Em pele fotoenvelhecida, o TRPV1 é frequentemente super expresso.
Além disso, a ativação constante de TRPV1, por exemplo por radiação térmica e infravermelha, leva à regulação positiva de enzimas que destroem o colágeno na pele, o que pode levar ao envelhecimento prematuro da pele. Portanto, a solução é reduzir a ativação de TRPV1 em pele sensível a níveis normais para fortalecer o nível de tolerância e reduzir a sensação desconfortável da pele.
SensAmone P5 – Uma solução para a pele sensível derivada do veneno de anêmona do mar
A proteína de anêmona do mar acima mencionada é uma candidata perfeito para ajudar a reduzir a sensibilidade da pele inibindo uma reação excessiva do receptor de dor TRPV1. No entanto, a proteína de comprimento total é instável e muito grande para penetrar na pele, e colhê-lo de veneno de anêmona do mar não é viável para aplicações cosméticas. Deste modo, um peptídeo de cinco aminoácidos foi concebido pela Mibelle Biochemistry em colaboração com o Instituto Venomtech do Reino Unido, que são especialistas na descoberta de fármacos venosos. Este pentapeptídeo contém o local de ligação ao receptor TRPV1 ativo da proteína da anêmona do mar. Outra vantagem é a sustentabilidade através da produção sintética do peptídeo que não requer o uso de anêmonas do mar.
Para assegurar ainda mais estabilidade e biodisponibilidade, o pentapeptídeo foi incorporado num sistema de suporte de esfera macia baseado em manteiga de karité.
O novo ingrediente cosmético resultante, SenSamone P5 (INCI: Pentapeptide-59 (and) Hydrogenated Lecithin (and) Butyrospermum Parkii (Shea) Butter (and) Phenethyl Alcohol (and) Ethylhexylglycerin (and) Maltodextrin (and) Aqua/Water) é uma solução para aliviar a pele sensível e irritada.
Eficiente inibição do receptor de TRPV1
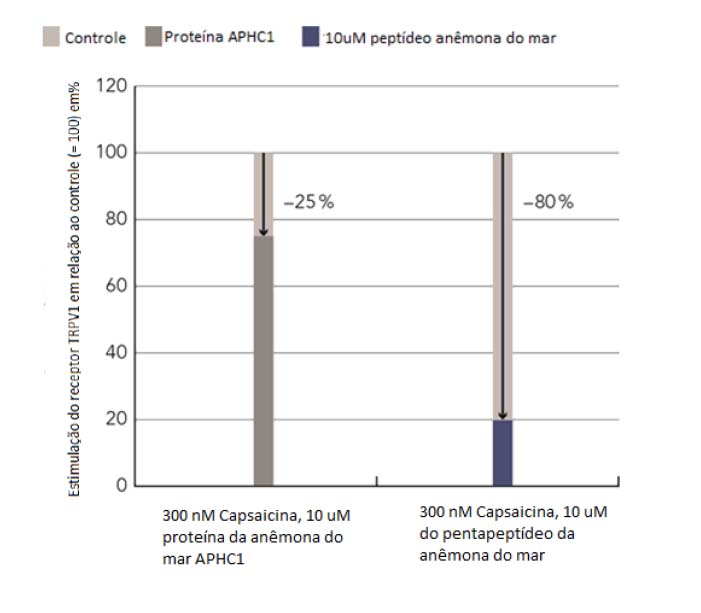
A capacidade de SensAmone P5 em inibir a ativação do receptor TRPV1 foi analisada em células CHO que expressam os receptores TRPV1 de uma forma estável. As células foram irritadas com capsaicina, que é um ativador de TRPV1, quer na presença ou ausência do pentapeptídeo da anêmona do mar (pentapeptide-59, RRRFV). O tratamento com a proteína de comprimento total anêmona de mar APHC1 na mesma concentração molecular foi utilizada como controle positivo. Os resultados mostraram que o tratamento com o pentapeptídeo inibiu a ativação do receptor TRPV1 em 80%, enquanto que o APHC1 de comprimento total, inibiu a ativação do receptor TRPV1 em 25%. Portanto, o peptídeo de anêmona do mar de cinco aminoácidos exibe ainda melhores propriedades de inibição de TRPV1 do que a proteína de comprimento total.
SensAmone P5 reduz instantaneamente a reatividade da pele após uma única aplicação
Num estudo duplo cego, controlado com placebo, 31 voluntários (mulheres, idade média de 47 anos) com creme aplicado em pele sensível com 2% de SensAmone P5 ou o placebo correspondente de cada lado da face. O limiar de percepção atual (CPT) foi medido usando um Neurometer duas horas após uma única aplicação e em comparação com o CPT inicial antes da aplicação. O Neurometer aplica um estímulo elétrico à pele em diferentes frequências (250Hz e 5Hz) para atingir diferentes células nervosas sensoriais. O CPT é então determinado como a quantidade de estímulo elétrico necessário para que seja sentida pelo voluntário. Como resultado, quanto maior o valor de CPT, significa que maior estímulo elétrico é necessário para ser sentida pelo voluntário, logo, menos reativa é a pele.
Uma única aplicação de 2% de SensAmone P5 aumentou significativamente o CPT da pele e reduziu assim a reatividade da pele.
Redução a longo prazo da sensibilidade cutânea com SensAmone P5
Para além do efeito calmante da pele a curto prazo do SensAmone P5, foi também investigado um efeito a longo prazo na redução da sensibilidade cutânea. Para isso, foi realizado um estudo clínico duplo cego placebo-controlado em que 31 voluntários (mulheres, idade média de 47 anos) com pele sensível, aplicaram um creme com 2% de SensAmone P5 ou o placebo correspondente de cada lado do seu rosto, duas vezes por dia durante num período de 28 dias.
Para medir a sensibilidade da pele, realizou-se um teste de sensibilização com ácido láctico aplicando uma solução aquosa de ácido láctico a 5% na dobra nasolabial e avaliando as sensações de queimação, ardor e coceira numa escala de quatro pontos a intervalos de um minuto durante um período total de nove minutos.
O tratamento com SensAmone P5 reduziu significativamente a sensibilidade da pele em mais de 26%. Portanto, SensAmone P5 pode ajudar a proteger a pele sensível de reagir exageradamente a estímulos ambientais.
SensAmone P5 é um inovador ativo cosmético inspirado pelo veneno da anêmona do mar e realizado pela ciência através da concepção de um pentapeptídeo em um sistema de entrega baseado em manteiga de Karité. SensAmone P5 reduz a sensibilidade e reatividade da pele inibindo a ativação do receptor da dor TRPV1 presente na pele. O resultado é uma pele suave e calma que é mais resistente ao estresse ambiental.
Texto Original: Mibelle Biochemistry
Tradução e Adaptação: Amanda Omodei, MKT Técnico, Focus Química
Publicação Original: Preview in-cosmetics London – Fev/2017.
 2A+ Cosmética Portal de notícias
2A+ Cosmética Portal de notícias